Pour Stephan
L'injection d'insuline : principes
La façon dont l'insuline injectée sous la peau va passer dans le sang dépend bien entendu du type d'insuline, mais aussi de plusieurs facteurs «techniques» :
• Profondeur de l'injection et épaisseur de la peau : une injection superficielle entraîne une libération retardée, une injection dans le muscle entraîne une libération accélérée.
• Site d'injection : la libération de l'insuline est plus rapide à certains endroits du corps qu'à d'autres.
• Activité des muscles situés au voisinage de la zone d'injection : cela accélère la libération de l'insuline.
 Profondeur de
l'injection
Profondeur de
l'injection
L'insuline doit être placée dans ce que l'on appelle le «tissu sous-cutané profond», c'est-à-dire dans partie la plus profonde de la peau, juste au-dessus du muscle, mais pas
dans le muscle, et ceci quelle que soit la longueur de l'aiguille et quelle que soit la technique d'injection sous-cutanée utilisée.
En effet, une injection faite dans le muscle entraîne une action plus rapide de l'insuline (et donc un risque d'hypoglycémie), tandis qu'une injection trop superficielle entraîne une action plus
lente de l'insuline (et donc une tendance à l'hyperglycémie suivie d'une action plus tardive pouvant entraîner une hypoglycémie s'il y a chevauchement avec l'action de l'insuline suivante).
D'autre part, plus l'injection est superficielle, plus il y a un risque que l'insuline ressorte par le point d'injection après que l'aiguille ait été sortie de la peau (ce qui entraîne une
hyperglycémie par suite d'une insuffisance d'insuline). De plus, une injection trop superficielle peut entraîner des phénomènes d'intolérance immunologique de la peau vis-à-vis de l'insuline.
Sur le plan pratique, les facteurs qui interviennent sont donc :
• l'épaisseur de la peau à l'endroit où on fait l'injection,
• la longueur de l'aiguille,
• l'angle de pénétration de l'aiguille (perpendiculaire à la peau, en oblique par rapport à la peau, ou presque parallèle à la peau),
• et la réalisation ou non un pli de peau pour y enfoncer l'aiguille.
Pendant de nombreuses années, on a utilisé des aiguilles assez longues, d'environ 18 à 24 mm car la technique d'injection usuelle pour tous les médicaments injectés sous la peau, consistait à
pincer la peau entre deux doigts, pour la soulever dans le but d'enfoncer l'aiguille dans l'axe du pli, à la base du pli, en tenant la seringue presque parallèle à la peau non soulevée. De cette
façon, l'insuline était placée sous la peau sans trop risquer de la placer dans le muscle. Cependant, cette technique était peu adaptée pour l'insuline car elle comportait un haut risque
d'injection à une profondeur variable avec des conséquences non négligeables sur le plan glycémique.
Par la suite, la technologie de fabrication des aiguilles le permettant, on a utilisé des aiguilles plus courtes (12,7 mm) et plus fines, et cela a permis de proposer différentes techniques
d'injection :
• soit à 45° par rapport à la peau, sans faire de pli, de façon à ce que l'insuline soit placée dans le tissu sous-cutané, sans aller jusque dans le muscle (le rôle de l'inclinaison de l'aiguille
étant d'éviter d'aller jusque dans le muscle),
• soit perpendiculairement à la peau, au sommet d'un pli de peau pincée entre deux doigts, sans prendre le muscle (le rôle du pli étant de soulever la peau au-dessus du muscle afin de ne pas
risquer de placer l'insuline dans le muscle),
• soit perpendiculairement à la peau en tendant la peau entre deux doigts (le rôle de cette tension étant d'aplatir le tissu sous-cutané dans les zones où le tissu sous-cutané est épais).
Ces dernières années, il a été possible de fabriquer des aiguilles encore plus fines et moins longues, d'autant que les études réalisées par scanner ont montré que la fréquence des injections où
l'insuline était en fait placée dans le muscle était plus importante qu'on ne le pensait. Ceci a donc conduit à proposer une autre technique d'injection : perpendiculaire à la peau, sans réaliser
un pli de peau, avec des aiguilles de 10 ou 8 mm. Par ailleurs, toutes les études ont montré que le vécu psychologique des injections était meilleur avec des aiguilles courtes qu'avec des
aiguilles longues.
Enfin, on fabrique maintenant également des aiguilles de 6 et 5 mm, mais elles sont à réserver aux enfants chez qui l'épaisseur de la peau est particulièrement faible, ou aux adultes
particulièrement maigres.
La technique d'injection a donc évolué d'une injection presque parallèle à la peau dans un pli avec des aiguilles longues, vers une injection perpendiculaire sans pli avec des aiguilles trois
fois plus courtes, après avoir consisté pendant une quinzaine d'années en une injection à 90° dans un pli, ou à 45° sans pli, ou à 90° sans pli, avec des aiguilles de longueur intermédiaire.
Il faut donc bien comprendre :
• que la réduction de la longueur (18 à 24 mm, 12,7 mm, 12 mm, 10 mm, 8 mm, 6 mm, 5 mm), ainsi que du diamètre des aiguilles, a été possible par suite de progrès technologiques dans la
fabrication des aiguilles,
• que la technique d'injection a évolué en conséquence,
• mais que le but de chaque technique est resté le même : placer l'insuline à une même profondeur sous la peau : le plus profond possible, mais sans atteindre le muscle.

|

|

|

|
|
Correct
|
Correct
|
Incorrect
|

|
Quelle que soit la longueur de l'aiguille, le but est le même :
placer l'insuline dans le tissu sous-cutané profond, sans atteindre le muscle
|
|
Pour une même épaisseur de peau, il existe une technique pour chaque longueur d'aiguille, dont le
but est de placer l'insuline à une même profondeur
|
 Epaisseur de la
peau
Epaisseur de la
peau
Qu'en est-il donc de l'épaisseur de la peau ? puisqu'il s'agit de placer l'insuline à une certaine
profondeur !
L'épaisseur du tissu sous-cutané est bien entendu différente chez chaque personne, ainsi que dans les différents lieux d'injection possibles, et elle est également différente chez l'homme et chez
la femme (le tissu sous-cutané est plus épais chez la femme).
Les zones d'injection sont essentiellement :
• la partie antérieure et externe des cuisses
• la partie supérieure et externe des bras,
• les parties basses et externes de l'abdomen (sauf au pourtour de l'ombilic),
• la partie haute des fesses.
L'épaisseur moyenne est :
• au niveau des cuisses : de 7 mm chez l'homme et de 14 mm chez la femme,
• au niveau des bras : de 9 mm chez l'homme et de 15 mm chez la femme,
• au niveau de l'abdomen : de 14 mm chez l'homme et de 23 mm chez la femme.
• au niveau des fesses : plus de 20 mm, tant chez l'homme que chez la femme.
Mais ces chiffres ne sont que des moyennes, et l'épaisseur du tissu sous-cutané est en fait très différente selon les personnes, avec cependant des éléments constants : le tissu sous-cutané des fesses est plus épais que celui de l'abdomen, qui est lui-même plus épais que celui des bras, qui
est lui-même un peu plus élevé que celui des cuisses.

|
Epaisseur du tissu sous-cutané :
haut des fesses > abdomen
> bras > cuisses
|
 Quelle longueur
d'aiguille et quelle technique choisir ?
Quelle longueur
d'aiguille et quelle technique choisir ?
Pratiquement tous les diabétiques (et tous les diabétologues !) sont d'accord sur le fait que plus l'aiguille est courte, mieux est vécue l'injection sur le plan psychologique. Le problème n'est
pas la douleur, car elle est identique quelle que soit la longueur de l'aiguille. En effet, on sait que la sensation douloureuse au niveau de la peau est transmise par la partie la plus
superficielle de la peau, et que l'avancée de quelques millimètres, ou même centimètres, supplémentaires sous la peau n'augmente pas la sensation douloureuse. Les études qui ont été faites,
d'injections «en aveugle», c'est-à-dire sans voir l'aiguille utilisée, ont d'ailleurs montré que la douleur ressentie est identique quelle que soit la longueur de l'aiguille. Par contre, chez les
mêmes personnes, les aiguilles les plus courtes étaient estimées moins douloureuses lorsque l'aiguille pouvait être vue.
A l'inverse, il est certain :
• que plus l'aiguille est courte, plus il y a un risque que l'insuline injectée ressorte par l'endroit où avait pénétré l'aiguille, avec pour conséquence une tendance hyperglycémique par suite
d'une dose incomplète,
• que plus la peau est épaisse, plus l'insuline sera placée trop superficiellement, avec pour conséquence une tendance hyperglycémique dans les heures suivant l'injection, et éventuellement une
tendance hypoglycémique en relation avec de l'insuline libérée tardivement,
• qu'une injection à 45° placera l'insuline à une moindre profondeur qu'une injection à 90°, mais une injection à 45° avec une aiguille de 12,7 mm placera en fin de compte l'insuline à une
profondeur identique à une injection à 90° avec une aiguille de 8 mm ; d'autre part, il est moins pratique de positionner une seringue ou un stylo à 45° qu'à 90°, et si on se pique en oblique, il
est probable que l'on aura pas tous les jours un angle de 45°.
Autrement dit :
• Le choix d'une aiguille de 8 mm ou 12,7 mm dépend essentiellement de l'épaisseur du tissu sous-cutané (c'est-à-dire en fait de l'existence ou non d'un excès de poids) et du souhait ou non de
réaliser un pli.
• Toutes les variantes sont possibles :
- entre une injection avec des aiguilles de 8 mm dans un pli avec un angle de 45° (injection la moins profonde),
- et une injection avec des aiguilles de 12,7 mm avec un angle de 90° en tendant la peau entre deux doigts (injection la plus profonde).
• Comme l'épaisseur de la peau n'est pas la même dans les différentes régions d'injection, il est possible d'adopter une technique différente pour chaque région, mais il faut garder la même
technique pour chaque région. Par exemple :
- cuisse : 8 mm à 90° dans un pli
- bras : 8 mm à 45° sans pli (à défaut de pouvoir faire soi-même un pli)
- abdomen : 8 mm à 90° dans un pli (si pas d'excès de poids) ou sans pli (si excès de poids)
- haut des fesses : 8 mm à 90° sans pli et en tendant la peau.
• Quelles que soient la longueur de l'aiguille et la technique d'injection, l'aiguille doit être enfoncée sur toute sa longueur afin d'assurer une profondeur suffisante et constante à
l'injection.
• Lorsqu'on fait un pli de peau, le but est de soulever la peau sans prendre le muscle afin que l'aiguille n'atteigne pas le muscle (il ne servirait en effet à rien de faire un pli de peau
prenant le muscle). Pour cela, l'expérience montre qu'il vaut mieux :
- utiliser seulement le pouce, l'index et le majeur pour pincer la peau (et non le pouce et les quatre autres doigts)
- et ne pas écarter le pouce et l'index de plus de 3 cm pour prendre la peau qui deviendra un pli (si cette distance est plus grande, le pli prend le muscle).
De plus, il faut maintenir le pli pendant que l'on injecte l'insuline, et le maintenir jusqu'à ce que l'aiguille soit sortie de la peau (car si on relâche le pli avant que l'aiguille ne soit
sortie, il y a un risque que l'aiguille aille dans le muscle).

|

|

|
|
Correct
|
Incorrect
|
• Lorsque l'injection a été réalisée, il faut laisser l'aiguille sous la peau pendant au moins cinq secondes (le temps de compter lentement jusqu'à 5, ou rapidement jusqu'à 10 !) afin que
l'insuline «trouve sa place» sous la peau et qu'elle ne ressorte pas de la peau lorsque l'on sort l'aiguille de la peau (et si on avait réalisé un pli de peau il faut maintenir ce pli jusqu'à ce
que l'aiguille soit sortie de la peau).

|
Différentes techniques d'injection sont possibles avec des aiguilles de 8, 10, 12 ou 12,7 mm, à
90° ou 45°, dans un pli de peau ou non.
La technique peut être différente pour les différentes régions du corps, mais il est souhaitable d'utiliser la même technique pour chaque région du corps.
L'objectif est de placer l'insuline dans le tissu sous-cutané profond, au voisinage du muscle, mais pas dans le muscle.
|
|

Il est indispensable de ne pas retirer l'aiguille dès que l'insuline a été injectée.
Il faut attendre 5 à 10 secondes avant de sortir l'aiguille de la peau.
|
http://www.diabsurf.com/diabete/FDgDiab.php



























 Nicolas Lefrançois, 28 ans, ex-champion de Normandie de… boxe (moins de 86 kilos) et
Nicolas Lefrançois, 28 ans, ex-champion de Normandie de… boxe (moins de 86 kilos) et  le Breton Corentin Cherhal, 21 ans
le Breton Corentin Cherhal, 21 ans



 Nom commun : Aneth, Aneth odorant, Faux anis, Fenouil bâtard
Nom commun : Aneth, Aneth odorant, Faux anis, Fenouil bâtard














 Propriétés et indications de l'huile essentielle d'angélique
Propriétés et indications de l'huile essentielle d'angélique









 www.grandfrais.com/valeurs/valeurs-1-112.html
www.grandfrais.com/valeurs/valeurs-1-112.html 
 Abbott SA / NV
Abbott SA / NV

























































































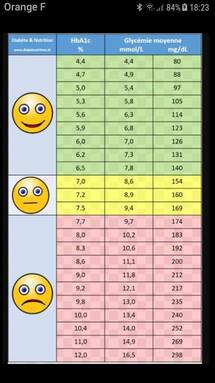





 Une consultation doit
s’imposer rapidement lorsque survient toute une série de gênes, qui handicapent la vie quotidienne. Il peut s’agir de
Une consultation doit
s’imposer rapidement lorsque survient toute une série de gênes, qui handicapent la vie quotidienne. Il peut s’agir de 
 "Il faut bien faire la différence entre troubles
du
"Il faut bien faire la différence entre troubles
du 
















 Les maladies rares touchent chacune peu de personnes par rapport à la population générale. En Europe, le seuil admis est d’une personne atteinte
sur 2 000, soit pour la France moins de 30 000 personnes atteintes de la même maladie. Partant de cette définition, certaines maladies peuvent être rares en France ou en Europe mais ne
pas avoir ce statut ailleurs. Ainsi, la lèpre est une maladie rare en France mais fréquente en Afrique centrale. De la même manière, l’anomalie génétique à l’origine de la thalassémie (défaut de
synthèse de l’hémoglobine) est rare dans le Nord de l’Europe mais fréquente autour de la Méditerranée.
Les maladies rares touchent chacune peu de personnes par rapport à la population générale. En Europe, le seuil admis est d’une personne atteinte
sur 2 000, soit pour la France moins de 30 000 personnes atteintes de la même maladie. Partant de cette définition, certaines maladies peuvent être rares en France ou en Europe mais ne
pas avoir ce statut ailleurs. Ainsi, la lèpre est une maladie rare en France mais fréquente en Afrique centrale. De la même manière, l’anomalie génétique à l’origine de la thalassémie (défaut de
synthèse de l’hémoglobine) est rare dans le Nord de l’Europe mais fréquente autour de la Méditerranée.
 Tout d'abord, il est important de rappeler que "personne ne résiste à l'
Tout d'abord, il est important de rappeler que "personne ne résiste à l'


